임상시험 자료관리 이용안내
임상시험 자료관리의 주요업무와 이용절차를 안내해드립니다 .
업무소개
ICH-GCP 가이드라인에 맞는 자료관리 표준작업지침을 갖추고 CRF/e-CRF 개발, 자료 검증 등 임상시험 자료를 효율적으로 관리할 수 있도록 연구자의 편의를 돕고 있습니다.
이용절차

담당자 연락처
임상약리센터 자료처리팀
063-259-3360 / [email protected]
주요 서비스
Phase I ~ Phase IV, OS (Observational Study), IIT (Investigator-Initiated Trial), PMS (Post-Marketing Study) 등
• eCRF (Electronic Case Report Form) Development
• DMP (Data Management Plan) Development
• Data Validation
• Query Management
• Medical Coding
• Database Lock
• Data Transformation including CIDSC SDTM (Study Data Tabulation Model) & Define-xml Format for Regulatory Submission
• Data Back-Up & Archiving
전문인력
• 인원: 전담 5명
• 자격 보유 현황
| EDC | CDISC | MedDRA | SAS | |
|---|---|---|---|---|
| Medidata RAVE | CRScube cubeCDMS | |||
| Medidata RAVE® Certified Study Builder | cubeBuilder Training Course | SDTM Theory and Application | Certified MedDRA Coder | SAS Certified Base Programmer for SAS 9 |
| Medidata RAVE® Custom Function Programming | - | Define-XML | - | - |
| Medidata Coder Basics | - | Controlled Terminology | - | - |
• 교육 이수 현황
| 교육명 | 주관기관 |
|---|---|
| Data Management(공통심화) 과정 | 한국임상시험산업본부 |
| CDISC Public Course – SDTM Theory and Application | CDISC(Clinical Data Interchange Standards Consortium) |
| CDISC Public Course – Define-XML | |
| CDISC Public Course – Controlled Terminology |
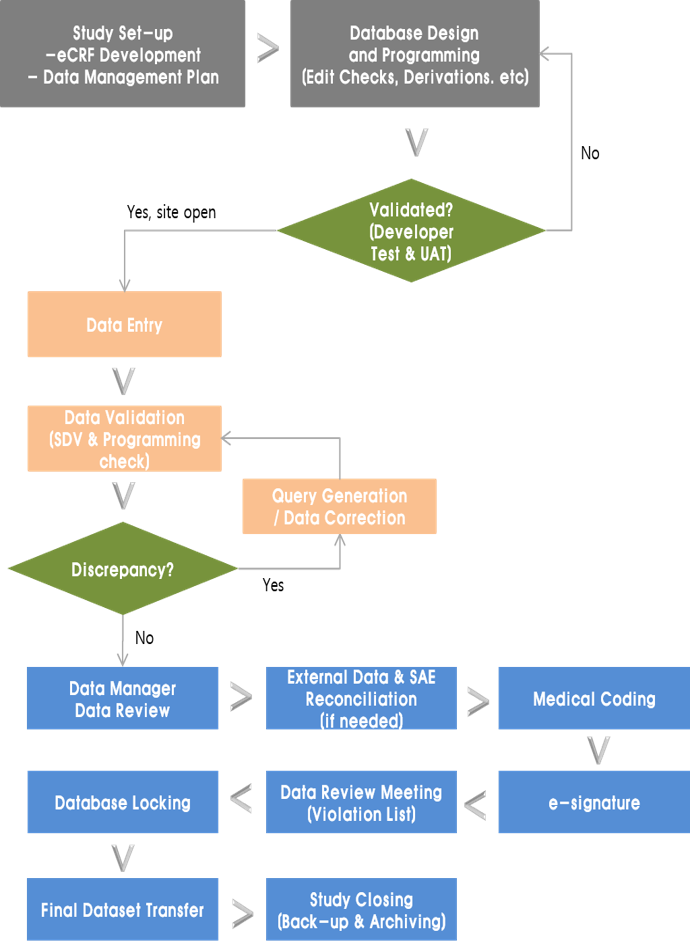
Process
Software
• Medidata Rave®, Medidata Batch Uploader, Medidata RAVE CODER
• CRScube cubeCDMS, CRScube cubeBUILDER, CRScube cubeIWRS, CRScube cubePRO
• Medical coding: MedDRA, WHOART, WHOCC
• Data validation: SAS, R
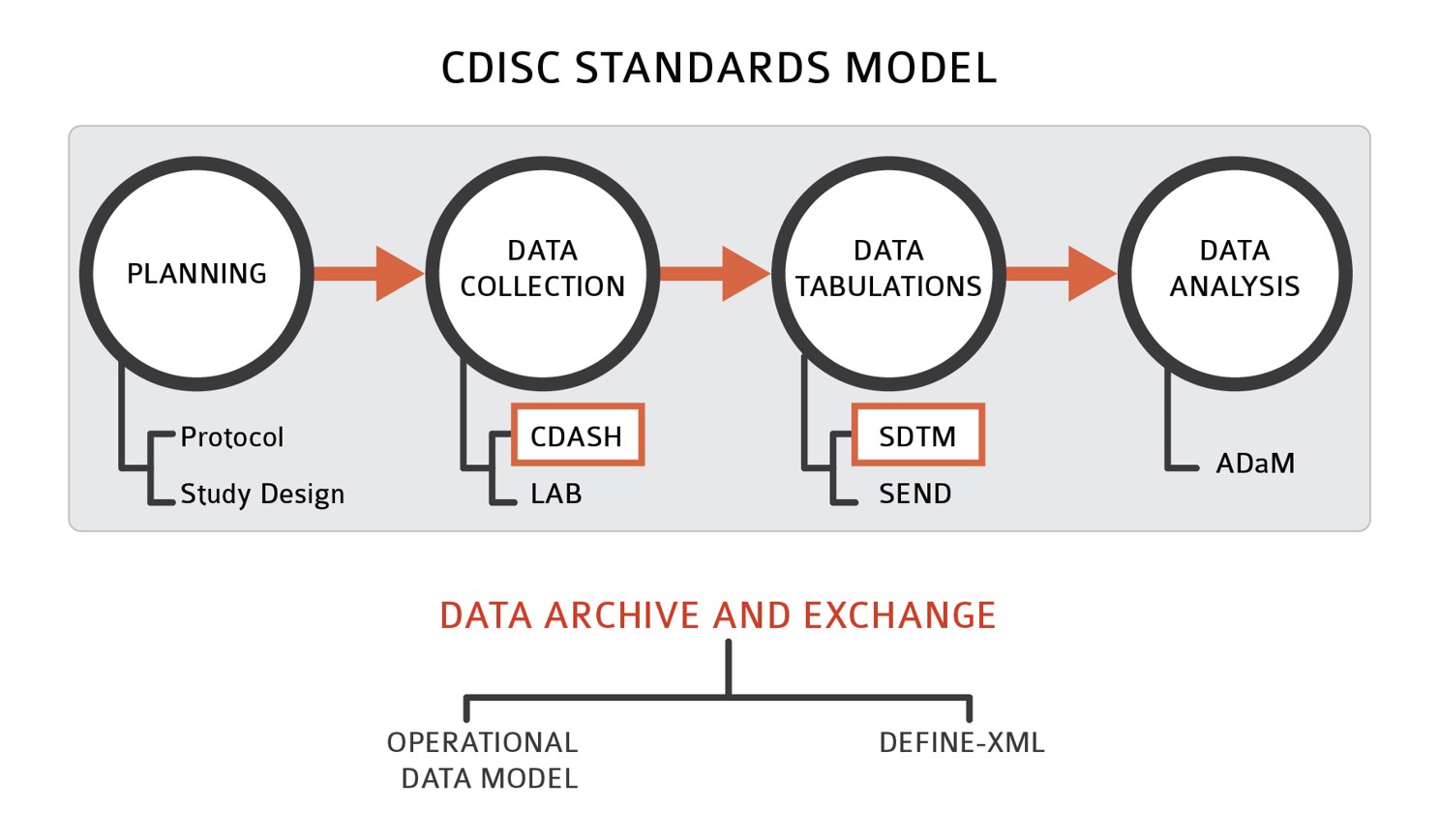
Global Standard Requirement Satisfied
• FDA 및 PMDA가 채택하고 있는CDISC(Clinical Data Interchange Standards Consortium) SDTM(Study Data Tabulation Model)을 적용 및 변환 가능한 Global 수준의 데이터 품질을 제공
실적
• 2010년부터 170여건의 자료관리 업무 수행
• 년도별 수행실적
• 단계별 수행실적